Ewing sarcoma là một bệnh ung thư xâm lấn ở trẻ em đặc biệt khó điều trị và đã có rất ít tiến bộ trong việc phát triển các liệu pháp hiệu quả cho những bệnh nhân mắc bệnh đã lan rộng hoặc tái phát sau khi điều trị. Sự thiếu tiến bộ đó một phần có liên quan đến những thách thức trong việc phát triển các loại thuốc có thể ngăn chặn hoạt động của một loại protein tổng hợp được gọi là EWS-FLI1, loại protein chịu trách nhiệm cho phần lớn các khối u Ewing sarcoma.
Giờ đây, bằng cách sử dụng phương pháp sàng lọc di truyền, hai nhóm nghiên cứu—một do Kimberly Stegmaier, MD, thuộc Viện Ung thư Dana-Farber đứng đầu, và nhóm kia do Christopher Vakoc, MD, Ph.D., thuộc Phòng thí nghiệm Cold Spring Harbor dẫn đầu—đã độc lập phát hiện ra rằng một protein được gọi là ETV6 dường như cũng đóng một vai trò quan trọng trong Ewing sarcoma.
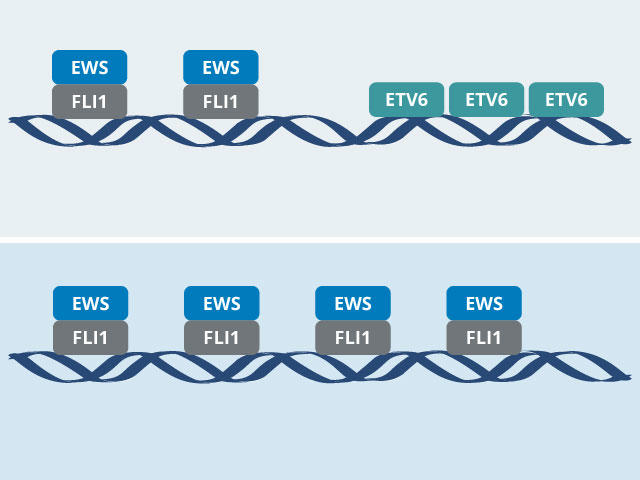
Cả hai nhóm đều phát hiện ra rằng ETV6 gián tiếp thúc đẩy sự phát triển của khối u bằng cách điều chỉnh hành vi của EWS-FLI1. Trong các thí nghiệm trên tế bào ung thư và chuột, các nhóm đã chỉ ra rằng, khi không có ETV6, EWS-FLI1 sẽ hoạt động quá mức. Nhưng thay vì thúc đẩy sự phát triển của khối u hơn nữa, tính hiếu động thái quá của EWS-FLI1 lại ngăn chặn sự phát triển của khối u.
Các nhà nghiên cứu hy vọng những hiểu biết mới này có thể được sử dụng để phát triển một loại thuốc nhắm mục tiêu can thiệp vào sự tương tác giữa ETV6 và EWS-FLI1 và có thể dẫn đến một phương pháp điều trị hiệu quả cho Ewing sarcoma.
Cả hai nghiên cứu đều được công bố vào ngày 19 tháng 1 trên tạp chí Nature Cell Biology .
Keren Witkin, Ph.D., thuộc Khoa Sinh học Ung thư của NCI, người không tham gia vào cả hai nghiên cứu, cho biết: “Việc phát hiện này đến từ hai phòng thí nghiệm một cách độc lập là sự xác nhận chắc chắn rằng đây là điều đáng để theo đuổi. “Đó là một bước tiến tốt đẹp, bởi vì nó mang lại cho chúng ta một nơi mới để tìm kiếm các chiến lược điều trị tiềm năng.”
Hơn nữa, Tiến sĩ Witkin tiếp tục, những nghiên cứu này đã giúp các nhà nghiên cứu có được bức tranh rõ ràng hơn về những gì đang diễn ra ở cấp độ phân tử trong Ewing sarcoma, điều này có thể cung cấp manh mối về những gì đang xảy ra trong các bệnh ung thư ở trẻ em khác được thúc đẩy bởi các protein tổng hợp.
Mở rộng truy quét đối tượng ma tuý
Ewing sarcoma là một loại ung thư hiếm gặp hình thành trong xương hoặc trong mô mềm xung quanh xương. Nó thường được chẩn đoán ở thanh thiếu niên và thanh niên và chiếm khoảng 2% trong số tất cả các bệnh ung thư ở trẻ em.
Bệnh thường được điều trị bằng hóa trị, phẫu thuật và xạ trị. Khi ung thư được chẩn đoán trước khi nó lan rộng, tỷ lệ sống sót sau 5 năm là khoảng 70%. Tỷ lệ sống sót thấp hơn nhiều khi bệnh đã lan rộng hoặc quay trở lại sau khi điều trị.
Và ngay cả khi bệnh nhân thuyên giảm, hóa trị và xạ trị thường để lại những tác động lâu dài, bao gồm cả những khuyết tật đáng kể và tăng nguy cơ mắc bệnh ung thư thứ hai. Vì vậy, các nhà nghiên cứu đã tập trung vào việc tìm cách tấn công trực tiếp vào các tế bào ung thư đồng thời giảm thiểu tác hại đối với các tế bào khỏe mạnh.
EWS-FLI1 là một yếu tố phiên mã, nghĩa là nó tham gia trực tiếp vào quá trình biểu hiện gen và nó điều chỉnh nhiều gen điều khiển Ewing sarcoma. Như thường xảy ra với các yếu tố phiên mã, các nhà nghiên cứu đã phải vật lộn để phát triển các loại thuốc có thể khóa EWS-FLI1 và đảo ngược tác động của nó đối với biểu hiện gen.
Như một giải pháp thay thế tiềm năng, thay vào đó, các nhà nghiên cứu đã tìm kiếm các cách gián tiếp làm gián đoạn hoạt động của protein dung hợp—cụ thể là bằng cách phá vỡ các protein khác mà EWS-FLI1 dựa vào để thực hiện các chức năng của nó. Một cách tiếp cận để tìm ra những protein như vậy liên quan đến kỹ thuật sàng lọc di truyền có tên là CRISPR-Cas9.
Vào năm 2021, bằng cách sử dụng CRISPR-Cas9, nhóm của Tiến sĩ Stegmaier tại Dana-Farber đã phát hiện ra rằng một loại enzyme có tên TRIM8 dường như đóng một vai trò quan trọng trong sự phát triển của Ewing sarcoma. TRIM8, họ đã chỉ ra, có liên quan đến việc làm suy giảm EWS-FLI1, một quá trình giúp duy trì mức độ chính xác của protein tổng hợp mà các khối u cần để phát triển. Nếu không có TRIM8, mức độ protein tổng hợp sẽ tăng lên, gây độc cho các tế bào Ewing sarcoma.
“Đó là sinh học hấp dẫn,” Tiến sĩ Stegmaier nói. “Rất nhiều điều chúng tôi biết được về Ewing sarcoma và EWS-FLI1 gần đây có liên quan đến ‘hiện tượng Goldilocks’. Số lượng chính xác của protein tổng hợp là cần thiết để bắt đầu và duy trì bệnh. Quá nhiều hoặc quá ít protein EWS-FLI1 đều gây độc cho các tế bào Ewing sarcoma.”
Trong các nghiên cứu mới, cả hai nhóm đã sử dụng CRISPR-Cas9 để xác định một cách có hệ thống các gen mà tế bào Ewing sarcoma, chứ không phải tế bào bình thường, dựa vào đó để tồn tại. Cả hai đều tìm ra gen ETV6 và thông qua các thí nghiệm bổ sung, họ đã phát hiện ra lý do tại sao protein này lại quan trọng trong Ewing sarcoma: Protein ETV6 cạnh tranh liên tục với protein tổng hợp EWS-FLI1, mỗi protein cạnh tranh để liên kết với các đoạn DNA cụ thể nơi chứa các gen quan trọng. tham gia vào quá trình sinh trưởng và tồn tại của tế bào.
“ETV6 đang kiểm tra DNA của EWS-FLI1 và đó là một cơ chế quan trọng cho sự phát triển của khối u,” Diana Lu, Tiến sĩ, Trường Y Harvard, người đã thực hiện các nghiên cứu về ETV6 khi cô còn là sinh viên tốt nghiệp tại Dr. .Phòng thí nghiệm của Stegmaier.
“Một protein tắt DNA và protein còn lại bật nó lên. Và đó hóa ra là chìa khóa cho cơ chế phân tử này mà chúng tôi đã giải nén trong nghiên cứu,” Tiến sĩ Vakoc nói.
Là một yếu tố phiên mã, ETV6 cuối cùng có thể đưa ra những thách thức tương tự đối với các nhà nghiên cứu như EWS-FLI1: phát triển các loại thuốc có thể liên kết hiệu quả với nó.
Tuy nhiên, nhóm của Tiến sĩ Vakoc đã tạo ra một peptide, hoặc một chuỗi axit amin nhỏ, can thiệp vào một vùng cụ thể của protein ETV6 cần thiết cho hoạt động của nó. Trong nghiên cứu của họ, khi họ đưa peptide này vào các tế bào Ewing sarcoma, các tế bào này ngừng phát triển và bắt đầu mang các đặc tính của tế bào bình thường.
Ý nghĩa đối với các bệnh ung thư ở trẻ em khác
Tiến sĩ Witkin lưu ý rằng những nghiên cứu này chứng minh vai trò quan trọng của việc sàng lọc di truyền bằng các công cụ như CRISPR-Cas9 có thể đóng vai trò trong việc xác định các mục tiêu thuốc mới.
“Trong Ewing sarcoma, chúng tôi biết trình điều khiển, nhưng chúng tôi đã không thành công trong việc nhắm mục tiêu nó. Trong những trường hợp như thế này, phương pháp sàng lọc CRISPR-Cas9 thực sự cho phép bạn tìm thấy thứ gì đó khác cần thiết cho sự phát triển và tiến triển của bệnh ung thư, đồng thời cung cấp cho bạn các mục tiêu điều trị tiềm năng,” cô nói.
Cô tiếp tục, công việc này được hỗ trợ bởi Hiệp hội Fusion Oncoprotein trong Ung thư ở Trẻ em (FusOnC2). FusOnC2 là một sáng kiến được hỗ trợ bởi Cancer Moonshot SM do NCI đưa ra nhằm tập hợp các nhà nghiên cứu lại với nhau để hiểu rõ hơn về sinh học của các protein tổng hợp đóng vai trò quan trọng trong việc thúc đẩy bệnh ung thư ở trẻ em.
Tiến sĩ Stegmaier nghĩ rằng có thể có những mục tiêu khác cho Ewing sarcoma sẽ được phát hiện khi công nghệ sàng lọc tiến bộ. Cô lưu ý rằng họ đã tiến hành hầu hết quá trình sàng lọc thư viện CRISPR-Cas9 trong các tế bào được nuôi cấy trong phòng thí nghiệm, những tế bào này có thể hoạt động khác với các tế bào trong môi trường trao đổi chất phức tạp của một sinh vật sống. Bà cho biết, sàng lọc di truyền của các mô hình động vật có thể giúp các nhà nghiên cứu xác định các mục tiêu có thể đã bị bỏ sót trong các tế bào được nuôi cấy trong phòng thí nghiệm.
Tiến sĩ Witkin cho biết, từ góc độ bức tranh lớn hơn, sự tương tác tinh tế giữa EWS-FLI1 và ETV6 trong việc thúc đẩy sự phát triển của khối u có thể không phải là duy nhất đối với Ewing sarcoma.
Cô ấy nói: “Cơ chế cạnh tranh thú vị này giữa các yếu tố phiên mã cũng có thể liên quan đến các bệnh ung thư [thời thơ ấu] khác. Ví dụ, các nhà nghiên cứu tại Đại học Michigan ở Ann Arbor gần đây đã phát hiện ra rằng ETV6 có thể ảnh hưởng đến hành vi của một yếu tố phiên mã quan trọng trong dạng bệnh bạch cầu phổ biến nhất ở trẻ em.
Trong khi đó, Tiến sĩ Stegmaier và Tiến sĩ Vakoc đang thảo luận về các dự án hợp tác để chuyển những phát hiện của họ thành các phương pháp điều trị mới cho Ewing sarcoma có thể chỉ ra các phương pháp điều trị các bệnh ung thư ở trẻ em khác do các protein tổng hợp như EWS-FLI1 điều khiển.
Tiến sĩ Vakoc cho biết: “Không ai nên từ bỏ việc cố gắng tạo ra thuốc [mục tiêu đó] EWS-FLI1 [trực tiếp], nhưng hiện tại có những ứng cử viên khác”.