Nhiều bệnh ung thư đáp ứng với các liệu pháp nhắm mục tiêu cuối cùng trở nên kháng thuốc. Khi những loại thuốc này ngừng hoạt động, bệnh nhân thường có ít lựa chọn điều trị, nếu có.
Một nghiên cứu mới cho thấy có thể ngăn ngừa một số bệnh ung thư trở nên kháng thuốc với các liệu pháp nhắm mục tiêu. Nghiên cứu tập trung vào khối u ác tính di căn. Một số loại thuốc nhắm mục tiêu là phương pháp điều trị tiêu chuẩn cho dạng ung thư da tích cực này.
Khi ung thư được điều trị bằng các liệu pháp nhắm mục tiêu, một số tế bào khối u có thể sống sót. Khi các tế bào sống sót phục hồi, một lần nữa chúng sẽ bắt đầu phát triển và phân chia. Trong quá trình này, các tế bào có thể có những thay đổi di truyền cho phép chúng thoát khỏi tác dụng của các loại thuốc nhắm mục tiêu.
Trong nghiên cứu mới, các nhà nghiên cứu đã xác định một cơ chế mà các tế bào phát triển những thay đổi di truyền, được gọi là DNA ngoại nhiễm sắc thể (ecDNA) và sự sắp xếp lại bộ gen phức tạp, cần thiết để đạt được khả năng kháng thuốc nhắm mục tiêu. Họ phát hiện ra rằng một quá trình phân tử bên trong tế bào được gọi là liên kết đầu cuối không tương đồng (NHEJ) có thể đóng vai trò quan trọng đối với những thay đổi di truyền cụ thể này diễn ra.
Trong các tế bào khỏe mạnh, con đường NHEJ này giúp sửa chữa các loại tổn thương cụ thể đối với DNA. Nhưng một số tế bào khối u ác tính dường như phụ thuộc rất nhiều vào con đường NHEJ để tạo ra các bản sao bổ sung của gen có thể chịu trách nhiệm kháng thuốc, theo kết quả được công bố trên Cancer Discovery vào ngày 26 tháng 1.
Nhà điều tra nghiên cứu Roger Lo, MD, Ph.D., thuộc Trung tâm Ung thư Toàn diện Jonsson của UCLA cho biết: “Các bệnh ung thư có thể tìm ra những cách tốt nhất để khắc phục tác dụng của thuốc bằng cách trải qua quá trình tiến hóa phân tử. “Không thể tránh khỏi, các tế bào ung thư có khả năng tạo ra nhiều phiên bản của chính chúng sẽ tình cờ gặp một số biến thể di truyền nhất định có khả năng chống lại một liệu pháp.”
Một cách tiếp cận mới cho một vấn đề lâm sàng khó khăn
Các nhà khoa học đã cố gắng phát triển các cách để xác định các lỗ hổng trong các khối u kháng thuốc khiến các khối u này nhạy cảm với các phương pháp điều trị. Nhưng tiến bộ đã bị hạn chế bởi sự đa dạng di truyền, hoặc tính không đồng nhất của bệnh ung thư.
Tiến sĩ Lo cho biết việc tìm ra phương pháp điều trị ung thư kháng thuốc “là một vấn đề lâm sàng khó khăn”, đồng thời lưu ý rằng nhiều con đường trong tế bào có thể dẫn đến kháng thuốc.
Một số bệnh nhân có thể có nhiều hơn một loại khối u kháng thuốc và trong mỗi khối u kháng thuốc, các con đường khác nhau có thể chịu trách nhiệm cho sự kháng thuốc. Tiến sĩ Lo cho biết: “Thật không may, khó có thể có một chiến lược hiệu quả duy nhất để điều trị các khối u kháng thuốc không đồng nhất ở những bệnh nhân này.
Tiến sĩ Lo và các đồng nghiệp của ông đã quyết định xem xét vấn đề một cách mới mẻ bằng cách phân tích bộ gen của các tế bào ung thư khi các tế bào này trở nên kháng thuốc nhắm mục tiêu.
Tiến sĩ Lo giải thích: “Chúng tôi muốn hiểu được điều gì đang thay đổi ở cấp độ bộ gen khi sức đề kháng phát triển. “Nếu chúng tôi biết những gì đã thay đổi trong bộ gen, chúng tôi nghĩ rằng chúng tôi có thể xác định các cơ chế làm phát sinh những thay đổi di truyền liên quan đến tính kháng thuốc.”
Anh ấy nói thêm, “Chúng tôi nghĩ rằng có thể hiệu quả hơn nếu hiểu nguyên nhân hơn là hậu quả của sự kháng cự.”
Tập trung vào các tế bào khối u ác tính có đột biến BRAF phổ biến
Để phân tích bộ gen của họ, các nhà nghiên cứu đã sử dụng các tế bào ung thư từ những bệnh nhân có khối u ác tính di căn. Các tế bào có một trong hai thay đổi di truyền cụ thể, BRAF V600 và NRAS Q61, khiến tế bào phát triển không kiểm soát và hiện diện trong 70% khối u ác tính di căn.
Một số sự kết hợp của các loại thuốc nhắm mục tiêu đã là phương pháp điều trị tiêu chuẩn cho khối u ác tính với đột biến BRAF V600. Tuy nhiên, ở hầu hết mọi người, các khối u cuối cùng trở nên kháng lại các phương pháp điều trị này. Các liệu pháp nhắm mục tiêu cho khối u ác tính có đột biến NRAS vẫn chưa có sẵn.
Để điều tra đặc điểm sinh học của tính kháng thuốc, Tiến sĩ Lo và các đồng nghiệp của ông đã giải trình tự bộ gen của các khối u ác tính ngay sau khi các tế bào tiếp xúc với liệu pháp kết hợp nhắm mục tiêu dành cho các khối u có đột biến BRAF V600. Để xem các bộ gen tiếp tục thay đổi như thế nào theo thời gian, các nhà nghiên cứu đã lặp lại trình tự sau khi các khối u ngừng phản ứng với thuốc.
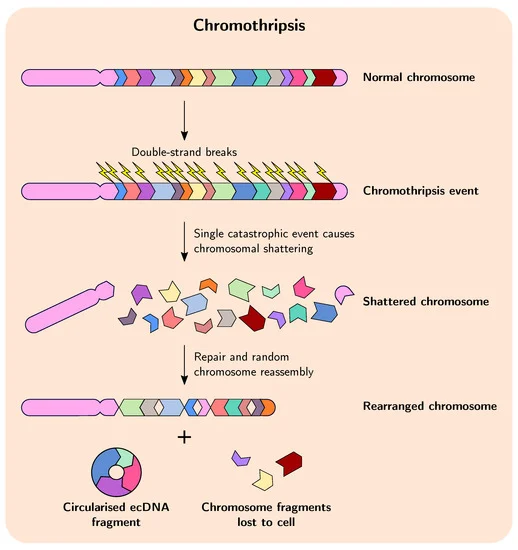
Để đáp ứng với các liệu pháp nhắm mục tiêu, các nhà nghiên cứu nhận thấy, bộ gen của một số tế bào khối u ác tính đã trải qua một quá trình được gọi là nhiễm sắc thể. Khi điều này xảy ra, các bit DNA có thể rơi ra khỏi nhiễm sắc thể và được gắn lại thành các phân tử hình tròn độc lập gọi là ecDNA.
Các tế bào ung thư có thể tạo ra nhiều bản sao của các ecDNA này—trong một số trường hợp lên đến 100 bản sao. ecDNA là một cách hiệu quả để các tế bào tăng số lượng bản sao của một số gen nhất định và khuếch đại hoạt động của những gen này.
Tiến sĩ Lo cho biết: “Chúng tôi tin rằng khi các tế bào được điều trị bằng các liệu pháp nhắm mục tiêu, một số phần nhất định của bộ gen sẽ trải qua quá trình phá vỡ và nối lại. Kết quả là, các gen quan trọng thúc đẩy tính kháng thuốc có thể có mặt trong ecDNA với số lượng lớn.
Anh ấy nói thêm, con đường NHEJ dường như đóng một vai trò quan trọng trong việc sắp xếp lại.
Ngăn ngừa kháng thuốc ở chuột
Sau khi xác định vai trò có thể có của con đường NHEJ và ecDNA trong việc kháng thuốc, các nhà nghiên cứu đã thử nghiệm một chiến lược ngăn chặn NHEJ trong tế bào và trong mô hình động vật. Họ đã sử dụng một loại thuốc ức chế protein có tên là DNA-PK, protein này rất cần thiết cho hoạt động của con đường NHEJ.
Ở những con chuột được cấy tế bào khối u ác tính mang đột biến BRAF V600 hoặc NRAS Q61, chất ức chế DNA-PK đã trì hoãn hoặc ngăn chặn sự phát triển của tính kháng thuốc nhắm mục tiêu.
“Khi bạn ức chế con đường NHEJ, các tế bào ung thư sẽ không có cơ hội trở nên kháng thuốc nhắm mục tiêu BRAF hoặc NRAS,” Sundar Venkatachalam, Ph.D., thuộc Phòng Chẩn đoán và Điều trị Ung thư của NCI, cho biết. không tham gia vào nghiên cứu.
Tiến sĩ Venkatachalam tiếp tục: “Đây là một nghiên cứu quan trọng giải quyết vấn đề lâm sàng quan trọng về khả năng kháng các liệu pháp nhắm mục tiêu. “Kết quả cho thấy các tế bào ung thư đang chiếm quyền điều khiển bộ máy sửa chữa DNA của chúng vì lợi ích của chúng.”
Các nhà nghiên cứu cũng phát hiện ra rằng con đường NHEJ có thể đóng một vai trò tương tự trong một số bệnh ung thư phổi và tuyến tụy. Tiến sĩ Venkatachalam cho biết: “Chiến lược cố gắng ngăn chặn tình trạng kháng thuốc có thể được áp dụng cho các loại ung thư khác nếu các cơ chế phân tử dẫn đến tình trạng kháng thuốc liên quan đến con đường NHEJ.
Phát triển thử nghiệm lâm sàng
Tiến sĩ Lo và các đồng nghiệp của ông đang phát triển một thử nghiệm lâm sàng để kiểm tra chất ức chế DNA-PK ở những bệnh nhân bị u ác tính. Nghiên cứu sẽ xem liệu việc cung cấp chất ức chế DNA-PK cùng với các liệu pháp nhắm mục tiêu có thể giúp trì hoãn hoặc ngăn chặn sự kháng thuốc của khối u hay không.
Tiến sĩ Lo cho biết: “Khi số lượng thuốc điều trị ung thư nhắm mục tiêu tiếp tục tăng lên, vấn đề kháng thuốc cũng sẽ gia tăng. “Đối với bệnh nhân của chúng tôi, có một nhu cầu cấp thiết về những cách mới để giải quyết vấn đề.”

 Phóng to
Phóng to









