Vào ngày 2 tháng 10, Cục Quản lý Thực phẩm và Dược phẩm (FDA) đã cấp phép cấp tốc cho pembrolizumab (Keytruda®) để điều trị cho bệnh nhân ung thư phổi không phải tế bào nhỏ di căn (NSCLC) có khối u biểu hiện protein gọi là PD-L1 và ung thư tiến triển sau bạch kim -dựa trên hóa trị.
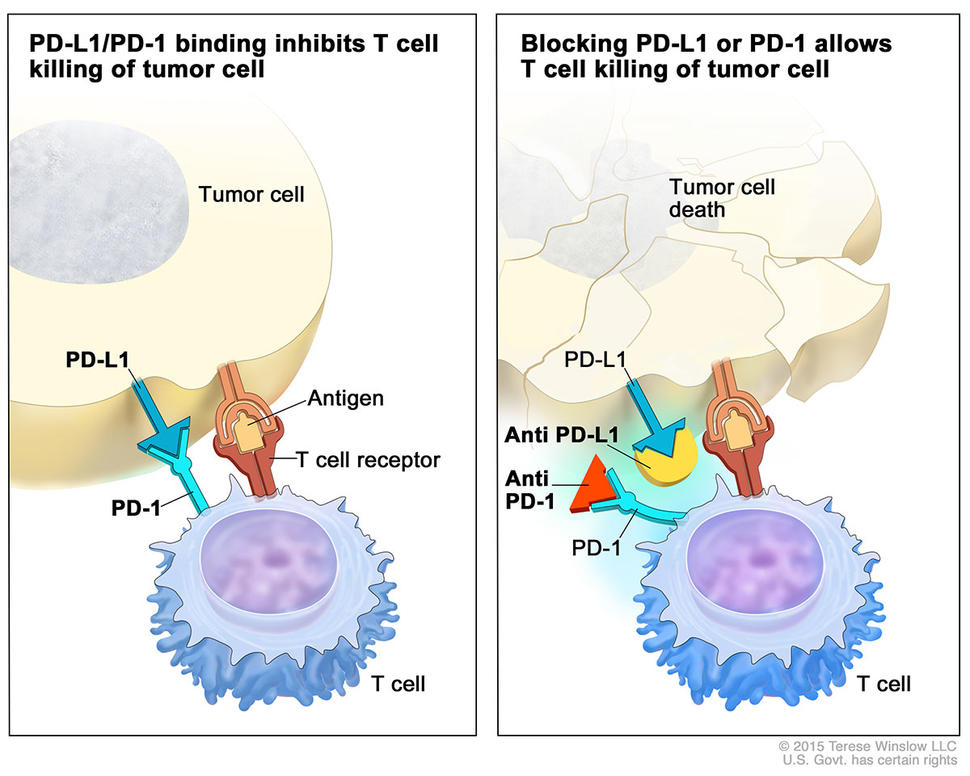
Pembrolizumab nhắm đến một loại protein trên các tế bào miễn dịch có tên là PD-1, một trong những họ protein được gọi là điểm kiểm soát có thể hạn chế phản ứng miễn dịch. Khi phối tử PD-1, hoặc PD-L1, trên các tế bào khối u liên kết với PD-1 trên các tế bào của hệ thống miễn dịch, đường truyền tín hiệu PD-1 được kích hoạt, ức chế phản ứng miễn dịch. Bằng cách ngăn chặn sự tương tác này, pembrolizumab cho phép hệ thống miễn dịch nhận biết và tấn công các tế bào khối u.
Sự chấp thuận của FDA dựa trên phân tích phân nhóm gồm 61 bệnh nhân trong một thử nghiệm lâm sàng lớn có khối u biểu hiện quá mức PD-L1. Sau khi điều trị bằng pembrolizumab, kích thước khối u đã giảm ở 24 bệnh nhân (41%) và hiệu quả kéo dài đến 9,1 tháng.
Việc phê duyệt pembrolizumab cho chỉ định này yêu cầu sử dụng xét nghiệm chẩn đoán đồng hành có tên là PD-L1 IHC 22C3 pharmDx, được sử dụng để đo mức độ biểu hiện PD-L1 trong khối u của bệnh nhân.
Elad Sharon, MD, MPH, thuộc Chương trình Đánh giá Trị liệu Ung thư của NCI cho biết: “Việc phê duyệt chẩn đoán đồng hành cho pembrolizumab là cực kỳ quan trọng. “Chẩn đoán đồng hành này là xét nghiệm PD-L1 đầu tiên được FDA chấp thuận và nó sẽ thiết lập một tiêu chuẩn mới cho các xét nghiệm PD-L1 trong tương lai khi thời gian trôi qua. Việc chấp thuận chẩn đoán đồng hành có thể sẽ mang lại lợi ích không chỉ cho bệnh nhân mắc bệnh phổi ung thư, vì FDA có thể sẽ sử dụng nó như một tiêu chuẩn tham chiếu chung để kiểm tra tỷ lệ đáp ứng ở các loại ung thư khác nhau.”
Theo yêu cầu của FDA, Merck, công ty sản xuất pembrolizumab, đang tiến hành một thử nghiệm ngẫu nhiên để xác nhận tính an toàn và hiệu quả của pembrolizumab.
Tiến sĩ Sharon giải thích: Các thử nghiệm lâm sàng khác đang thử nghiệm pembrolizumab ở những bệnh nhân có khối u biểu hiện mức độ cao của PD-L1 và ở những bệnh nhân có khối u không biểu hiện PD-L1.
Ông nói: “Các chất ức chế PD-1 – và các loại thuốc liên quan được gọi là chất ức chế PD-L1 ảnh hưởng đến cùng một con đường – thường có mức độ phản ứng cao hơn và hiệu quả hơn ở những bệnh nhân có khối u biểu hiện PD-L1.
Pembrolizumab tương tự như một loại thuốc khác được FDA chấp thuận, nivolumab (Opdivo ® ), cũng nhắm mục tiêu PD-1 trên các tế bào của hệ thống miễn dịch. Tiến sĩ Sharon cho biết, chưa có thử nghiệm nào so sánh trực tiếp hai loại thuốc này, nhưng cả hai loại thuốc đều cho thấy hoạt động đối với một số bệnh ung thư ngày càng tăng và cả hai hiện đã được phê duyệt cho bệnh ung thư phổi tế bào ác tính và không phải tế bào nhỏ.
NCI hiện đang tài trợ cho các thử nghiệm để kiểm tra các loại thuốc này trong nhiều loại khối u khác. Ví dụ, kết quả sơ bộ từ một thử nghiệm pembrolizumab do NCI tài trợ ở bệnh nhân ung thư biểu mô tế bào Merkel được trình bày vào tháng 9 tại Đại hội Ung thư Châu Âu cho thấy 10 trong số 14 bệnh nhân có phản ứng khối u đáng kể, trong đó có hai bệnh nhân có phản ứng hoàn toàn.

 Phóng to
Phóng to








