Vào ngày 10 tháng 11, Cục Quản lý Thực phẩm và Dược phẩm (FDA) đã phê duyệt việc sử dụng cobimetinib (Cotellic™) kết hợp với vemurafenib (Zelboraf®) để điều trị bệnh nhân bị u ác tính di căn.
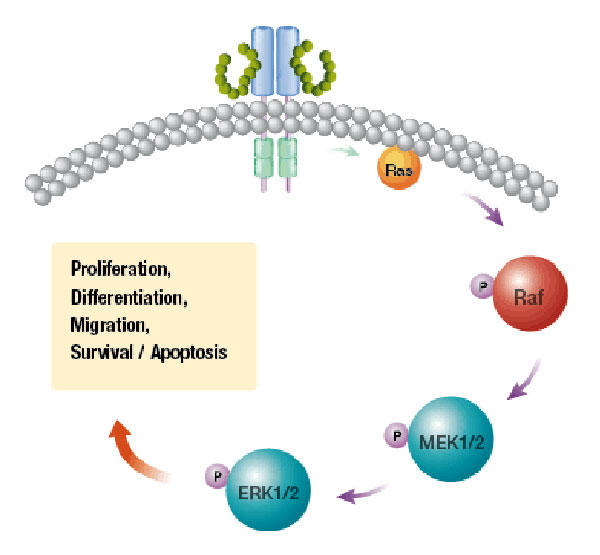
Cả hai loại thuốc đều chặn các mục tiêu hoạt động ở các bước khác nhau trong cùng một lộ trình truyền tín hiệu, protein kinase được kích hoạt bằng mitogen, hoặc MAPK, lộ trình. Cobimetinib ức chế hoạt động của một loại enzyme được gọi là MEK và vemurafenib ức chế enzyme BRAF.
Sự chấp thuận này dựa trên hiệu quả của cobimetinib cộng với vemurafenib trong một thử nghiệm lâm sàng ngẫu nhiên giai đoạn III trên 495 bệnh nhân có khối u có đột biến gen BRAF cụ thể và không phải là đối tượng để phẫu thuật.
Các bệnh nhân tham gia thử nghiệm lâm sàng đã nhận được vemurafenib—vốn đã được phê duyệt là một tác nhân duy nhất cho bệnh nhân mắc khối u ác tính tiến triển có khối u mang đột biến BRAF —kết hợp với cobimetinib hoặc giả dược.
Những bệnh nhân dùng vemurafenib cộng với cobimetinib có thời gian sống trung bình không bệnh tiến triển là 12,3 tháng, so với 7,2 tháng ở những bệnh nhân dùng vemurafenib cộng với giả dược.
Vào thời điểm 17 tháng sau khi bắt đầu điều trị, khoảng 65% bệnh nhân sử dụng kết hợp hai loại thuốc vẫn còn sống, so với 50% những người chỉ dùng vemurafenib.
Các tác dụng phụ phổ biến nhất ở những bệnh nhân dùng cả hai loại thuốc bao gồm tiêu chảy, nhạy cảm với ánh sáng và nôn mửa. Cobimetinib cũng có thể gây ra các tác dụng phụ nghiêm trọng, bao gồm tổn thương cơ tim hoặc các cơ khác, khối u da mới (khối u ác tính nguyên phát ở da), bong võng mạc, phát ban da nghiêm trọng và tổn thương gan.
Howard Streicher, MD, thuộc Chương trình Đánh giá Trị liệu Ung thư của NCI giải thích: Sự cải thiện về khả năng sống sót không tiến triển cho thấy rằng các khối u mất nhiều thời gian hơn để trở nên kháng cả hai loại thuốc được dùng cùng nhau hơn là chỉ dùng vemurafenib.
Với sự chấp thuận mới này, hiện có hai phương pháp điều trị ung thư được FDA chấp thuận kết hợp chất ức chế BRAF với chất ức chế MEK. Vào năm 2014, FDA đã phê duyệt dabrafenib (Tafinlar®) cộng với trametinib (Mekinist®) là liệu pháp đầu tay cho những bệnh nhân bị khối u ác tính di căn có đột biến BRAF .
Tiến sĩ Streicher cho biết: “Sự sẵn có của rất nhiều phương pháp điều trị mới cho khối u ác tính đã “làm tăng kỳ vọng cho bệnh nhân rằng khối u ác tính ở da có thể được điều trị và kiểm soát trong nhiều năm”.
Với một số loại thuốc trị liệu miễn dịch hiện đã được phê duyệt cho khối u ác tính, “một câu hỏi quan trọng là làm thế nào những sự kết hợp này sẽ được sử dụng cùng với các phương pháp điều trị dựa trên miễn dịch,” ông nói. “Cả hai cách kết hợp có thể được sử dụng trước hoặc sau chất ức chế trạm kiểm soát.” Tiến sĩ Streicher cho biết thêm, một thử nghiệm giai đoạn III do NCI tài trợ để kiểm tra trình tự nào hiệu quả nhất hiện đang thu hút nhiều bệnh nhân.

 Phóng to
Phóng to








